Устойчивый к лекарствам тип бактерий, который адаптировался к условиям медицинских учреждений, за последние несколько лет эволюционировал, превратившись в генетический инструмент борьбы с микроорганизмами, уничтожая своих собратьев и заменяя их в качестве доминирующего штамма. Учёные из Медицинской школы Питтсбургского университета сделали это открытие, изучая данные местных больниц, а затем подтвердили, что это глобальное явление. Это открытие, опубликованное сегодня в журнале Nature Microbiology, может стать толчком к разработке новых подходов к лечению некоторых из самых опасных в мире бактерий. Оно также подтверждает возможность нового применения системы, разработанной в Университете Питтсбурга и Университете Питтсбурга и Канзас-Сити, которая объединяет геномное секвенирование с компьютерными алгоритмами для быстрого выявления вспышек инфекционных заболеваний.
Наша лаборатория находится в первых рядах наблюдателей за парадом патогенов, которые циркулируют в больницах. И когда мы сделали шаг назад и посмотрели на ситуацию в целом, стало ясно, что с одной из самых трудноизлечимых бактерий в мире происходят большие изменения.
старший автор исследования Дарья Ван Тайн, доктор философии, доцент кафедры медицины в отделе инфекционных заболеваний Питтсбургского университета
Усовершенствованная система обнаружения передачи инфекции в медицинских учреждениях (EDS-HAT) анализирует генетические признаки инфекций у госпитализированных пациентов и выявляет закономерности, что позволяет врачам вмешиваться и останавливать потенциальные вспышки в режиме реального времени. Но ведущий автор исследования Эмма Миллс, аспирантка по микробиологии и иммунологии в лаборатории Ван Тайна, поняла, что EDS-HAT — это также сокровищница подробной исторической информации, которую она может использовать, чтобы изучать эволюцию бактерий с течением времени.
Миллс сосредоточился на устойчивом к ванкомицинуэнтерококке фециум (VREfm), названном так потому, что его нельзя уничтожить с помощью популярного антибиотика ванкомицина. VREfm убивает около 40% заражённых им людей и является настоящей чумой для пациентов с ослабленным иммунитетом и госпитализированных пациентов, которые часто принимают антибиотики, снижающие разнообразие бактерий в их микробиомах и позволяющие устойчивым к лекарствам бактериям, таким как VREfm, размножаться.
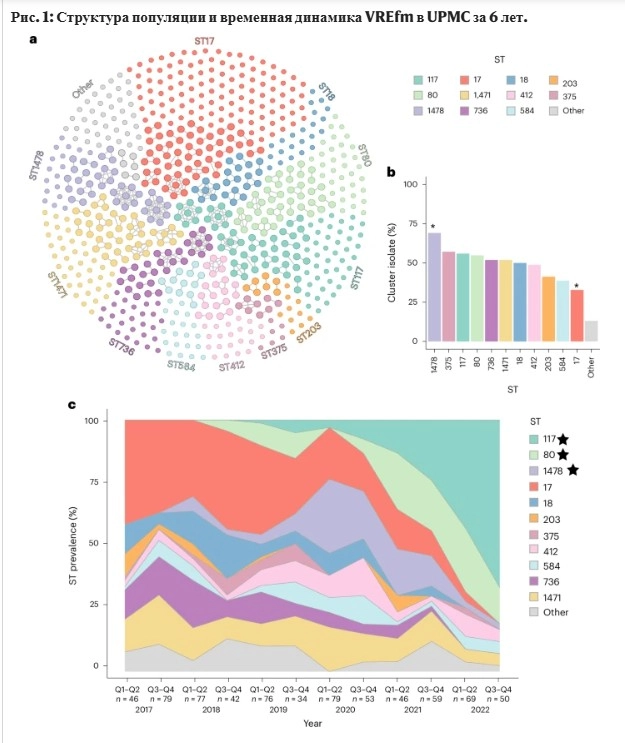
Проанализировав геномные последовательности 710 образцов VREfm, взятых у госпитализированных пациентов, участвовавших в программе EDS-HAT в течение шести лет, Миллс обнаружил, что разнообразие штаммов VREfm сократилось с примерно восьми довольно равномерно распределённых типов в 2017 году до двух доминирующих штаммов, которые начали появляться в 2018 году и к концу 2022 года стали причиной заражения четырёх из каждых пяти пациентов с VREfm.
При более тщательном изучении Миллс обнаружил, что доминирующие штаммы приобрели способность вырабатывать бактериоцин — противомикробное вещество, которое бактерии используют для уничтожения или подавления друг друга. Они использовали эту новую способность для уничтожения других штаммов VREfm, получая неограниченный доступ к питательным веществам для более лёгкого размножения. Если это происходило в местной больнице, то происходило ли это где-то ещё? Ни в одной из предыдущих научных публикаций не рассматривалась возможность того, что это глобальное явление, поэтому она обратилась к общедоступной библиотеке, содержащей более 15 000 геномов VREfm, собранных по всему миру с 2002 по 2022 год. И действительно, то, что она наблюдала в местной больнице, происходило и в глобальном масштабе.
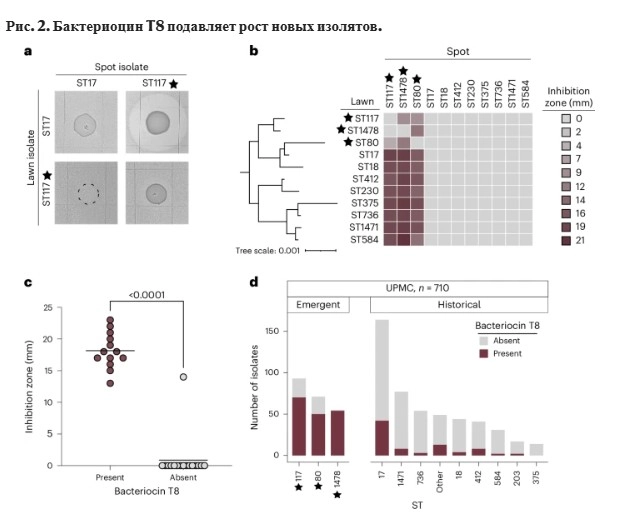
Это было совершенно неожиданное открытие — я был удивлён, увидев такой яркий сигнал. Как только эти штаммы попадают в стационарные учреждения, например в больницу, и сталкиваются с другими штаммами VRE в кишечнике пациента, они берут верх. Это сценарий "убей своих приятелей и съешь их еду.
ведущий автор исследования Эмма Миллс, аспирантка по микробиологии и иммунологии в лаборатории Ван Тайна
Ван Тайн сказал, что это открытие не имеет непосредственных клинических последствий — судя по всему, VREfm, обладающие бактериоцинами, не делают пациентов более больными, чем их предшественники. Но это может указывать на потенциальные возможности для разработки новых методов лечения. Разнообразие популяции VRE, по-видимому, сокращается: от множества различных типов, вызывающих инфекцию, к нескольким. Это означает, что вскоре у нас может остаться только одна цель для разработки терапевтических средств, таких как антибиотики или фаговая терапия. Это также говорит о том, что бактериоцины очень эффективны, и, возможно, мы могли бы использовать их в своих целях.
FAST обнаружил новую сверхтусклую карликовую галактику.

Фото: pxhere.com; University of Pittsburgh


Обсуждение ( 0 ) Посмотреть все