Солнечные ожоги и старение кожи — очевидные последствия воздействия вредных ультрафиолетовых лучей, табачного дыма и других канцерогенов. Но последствия проявляются не только на коже. Внутри организма ДНК буквально разрушается. Понимание того, как организм восстанавливается и защищается от повреждений ДНК, жизненно важно для лечения генетических нарушений и опасных для жизни заболеваний, таких как рак. Но, несмотря на многочисленные исследования и достижения в области медицины, многое в молекулярных механизмах восстановления ДНК остаётся загадкой.
В течение последних нескольких лет исследователи из Университета штата Джорджия использовали суперкомпьютер Summit в Национальной лаборатории Ок-Ридж Министерства энергетики для изучения сложного молекулярного механизма, называемого эксцизионной репарацией нуклеотидов (ЭРН). ЭРН использует множество высокодинамичных белковых комплексов для вырезания (эксцизии) повреждённой ДНК с хирургической точностью. В своём последнем исследовании, опубликованном в Nature Communications, команда учёных создала компьютерную модель важнейшего компонента NER, называемого предразрезным комплексом, или PInC. PInC играет ключевую роль в регулировании процессов восстановления ДНК на последних этапах пути NER. Расшифровка сложной последовательности событий NER и роли PInC в этом пути может дать ключевую информацию для разработки новых методов лечения и предотвращения состояний, которые приводят к преждевременному старению и некоторым видам рака.
Нас интересует, как клетки восстанавливают свой генетический материал. NER — это универсальный механизм, который восстанавливает все виды повреждений ДНК с помощью трёхэтапного процесса, основанного на тонко сбалансированном молекулярном механизме. К сожалению, могут развиться вредные мутации, которые нарушают работу этого механизма и вызывают тяжёлые заболевания у людей
ведущий исследователь Ивайло Иванов, профессор химии в Университете штата Джорджия
Экспери добавил, что последствия генетических мутаций могут быть совершенно разными в зависимости от их расположения в комплексах репарации. В некоторых случаях мутации приводят к тому, что пациенты становятся чувствительными к ультрафиолетовому излучению и имеют предрасположенность к раку. В других случаях они вызывают аномальное развитие и преждевременное старение. Ученымдо конца не понятно, почему это происходит на молекулярном уровне. Это загадка, которую специалисты пытаются разгадать с помощью компьютерного моделирования.
Три акта ремонта
NER состоит из трёх отдельных этапов: распознавание, проверка и восстановление. На каждом этапе для выполнения определённых функций требуются разные группы белков, подобно тому, как в травматологической бригаде есть разные специалисты, необходимые для лечения пациентов в отделении неотложной помощи. Таким образом, механизм NER может адаптироваться и менять свою форму в зависимости от поставленной задачи.
На первом этапе белок NER XPC (группа C при пигментной ксеродермии) действует как первый ответчик, который находит повреждённый участок ДНК, или дефект, а затем скручивает спираль ДНК, чтобы сделать дефект доступным. Затем XPC привлекает другие белки-репарирующие ферменты, чтобы инициировать второй этап, называемый проверкой повреждений или сканированием дефектов. Здесь белковый механизм NER принимает следующую форму. Когда XPC отступает, белковый комплекс, называемый фактором транскрипции IIH, или TFIIH (произносится как T-F-2-H), занимает своё место. TFIIH ещё больше раскручивает участок ДНК и сканирует вновь обнажившуюся цепь на наличие повреждений. После этого он попадает в руки хирурга — PInC — на третьем и последнем этапе восстановления.
После стабилизации состояния "пациента" и подготовки к операции можно приступать к удалению повреждённой нити ДНК. Два фермента, XPF и XPG (группы F и G при пигментной ксеродермии), располагаются точно по обе стороны от повреждения и действуют как молекулярные ножницы, вырезая повреждённый сегмент ДНК. Как только повреждение устранено, синтезируется новая ДНК, чтобы заполнить образовавшийся пробел. Наконец, основная цепь ДНК восстанавливается, и повреждённая ДНК приходит в норму.
Мы хотим знать, как PInC формируется после фазы сканирования повреждений. Как он контролирует расположение двух субъединиц фермента, которые выполняют двойной разрез повреждённой нити ДНК? И, что важно, есть ли взаимодействие между двумя ферментами? Чувствуют ли они друг друга?
ведущий исследователь Ивайло Иванов, профессор химии в Университете штата Джорджия
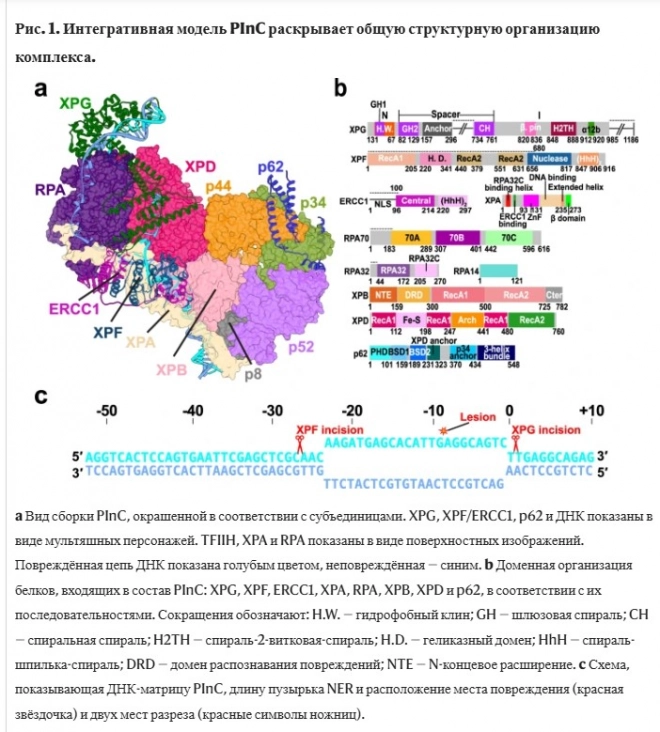
Этот момент важен, потому что после расщепления повреждённой нити ДНК крайне важно завершить процесс восстановления, заполнив этот пробел. В противном случае это приведёт к гибели клетки или к образованию двухцепочечных разрывов, которые крайне вредны для клетки. Для того, чтобы ответить на эти вопросы, исследователям нужно было определить структуру PInC. В биологии понимание структуры белка необходимо для понимания поведения или функций белковых комплексов. Форма, размер и взаимодействие белков определяют, как они соединяются друг с другом, образуя крупные биомолекулярные комплексы.
Мы интегрировали структурную модель PInC, используя данные, полученные с помощью различных биофизических методов, в частности криоэлектронной микроскопии. Но в конечном счёте именно вычисления объединяют всё воедино.
ведущий исследователь Ивайло Иванов, профессор химии в Университете штата Джорджия
Подобно кусочкам пазла, модель PInC нужно было собрать из известных структур входящих в неё белков, и все отдельные части нужно было соединить в трёхмерную модель. Однако многие компоненты PInC не имели известных экспериментальных структур. Чтобы решить эту задачу, исследователи использовали модель на основе нейронной сети под названием AlphaFold2 для прогнозирования неизвестных структур и интерфейсов между белками, которые удерживают PInC вместе.
Заключительные симуляции саммита
С точки зрения вычислений, после того как вы соберёте PInC, моделирование молекулярной динамики комплекса становится относительно простым, особенно на больших суперкомпьютерах, таких как Summit.
ведущий исследователь Ивайло Иванов, профессор химии в Университете штата Джорджия
Наноразмерная молекулярная динамика, или NAMD, — это код молекулярной динамики, специально разработанный для суперкомпьютеров и используемый для моделирования движений и взаимодействий крупных биомолекулярных систем, состоящих из миллионов атомов. С помощью NAMD исследовательская группа провела обширное моделирование. Вычислительная мощность суперкомпьютера Summit, способного выполнять 200 триллионов вычислений в секунду, была необходима для изучения функциональной динамики комплекса PInC в масштабе микросекунд.
Моделирование показало нам, насколько сложен механизм PInC. Оно показало нам, как эти различные компоненты взаимодействуют друг с другом в качестве модулей и как этот комплекс делится на динамические сообщества, которые образуют движущиеся части этой машины.
ведущий исследователь Ивайло Иванов, профессор химии в Университете штата Джорджия
Полученные результаты важны тем, что мутации в генах XPF и XPG могут приводить к серьёзным генетическим заболеваниям у людей. К ним относятся пигментная ксеродермия, которая делает людей более восприимчивыми к раку кожи, и синдром Коккейна, который может влиять на рост и развитие человека, приводить к ухудшению слуха и зрения и ускорять процесс старения.
Моделирование позволяет нам сосредоточиться на этих важных областях, потому что мутации, нарушающие работу комплекса NER, часто возникают на границах сообществ, которые являются наиболее динамичными областями машины. Теперь мы гораздо лучше понимаем, как и откуда возникают эти нарушения.
ведущий исследователь Ивайло Иванов, профессор химии в Университете штата Джорджия
Большинство симуляций молекулярной динамики выполнялось на Summit. Однако после 6 лет производства Summit был снят с производства в конце 2024 года. Заглядывая в будущее, Иванов и его команда планируют использовать преемника Summit, Frontier, суперкомпьютер экзафлопсного класса, который дебютировал как самый мощный суперкомпьютер в мире, когда был запущен в 2022 году. Их работа в Frontier будет включать изучение NER, связанного с транскрипцией, — процесса восстановления ДНК, который устраняет повреждения в активно транскрибируемых генах, чтобы обеспечить непрерывное производство необходимых белков.
На дне моря найдены возможные доказательства недоказанной теории чёрных дыр Стивена Хокинга.
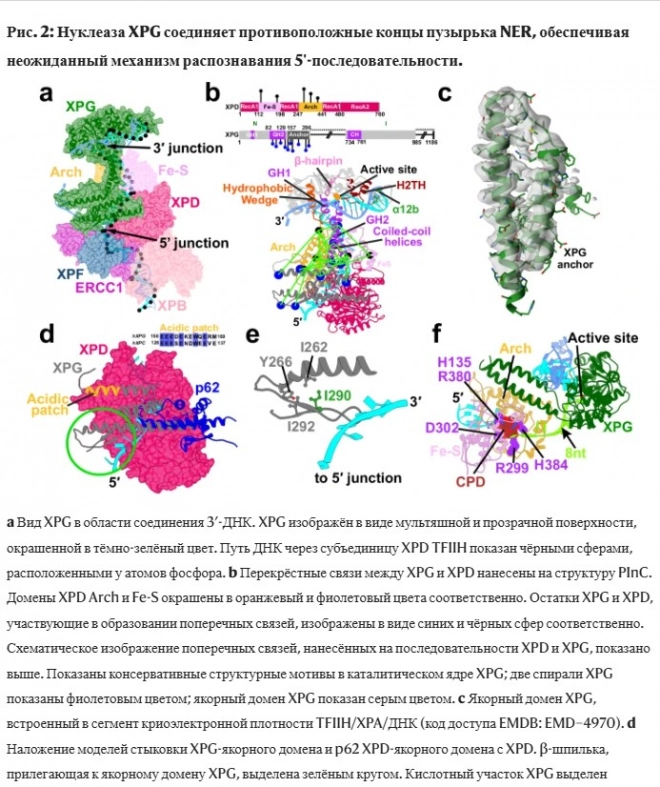
Фото и видео: Nature Communications (2024). DOI: 10.1038/s41467-024-52860-y


Обсуждение ( 0 ) Посмотреть все