Исследователи из Калифорнийского университета в Ирвайне разработали систему Phollow для визуализации в реальном времени, которая отслеживает распространение отдельных бактериофагов в кишечнике рыбок данио. Бактериофаги, или фаги, — это вирусы, которые заражают и убивают бактерии. Они являются самыми многочисленными биологическими объектами на Земле и одними из первых колонизируют кишечник человека. Фаги играют несколько ролей в микробиоме человека: они могут влиять на динамику популяций микроорганизмов, выступать в качестве формы врождённой иммунной модуляции у новорождённых и повышать жизнеспособность бактерий, способствуя горизонтальному переносу генов.
Контролируемые вспышки фагов потенциально могут способствовать распространению полезных микроорганизмов или использоваться для уничтожения местных микробов, которые становятся вредными при определённых условиях. Для продуктивного использования вспышек фагов необходимо всесторонне изучить динамику передачи, то есть то, как фаги размножаются внутри одного носителя, распространяются на других и влияют на бактериальные сообщества. Изучение динамики передачи является технически сложной задачей, поскольку факторы, определяющие репликацию и передачу фагов на месте, в значительной степени неизвестны. Без контекстуального понимания места и продолжительности репликации фагов, а также того, являются ли фаги внеклеточными вирионами или внутриклеточными профагами, прогресс в этой области сильно ограничен.
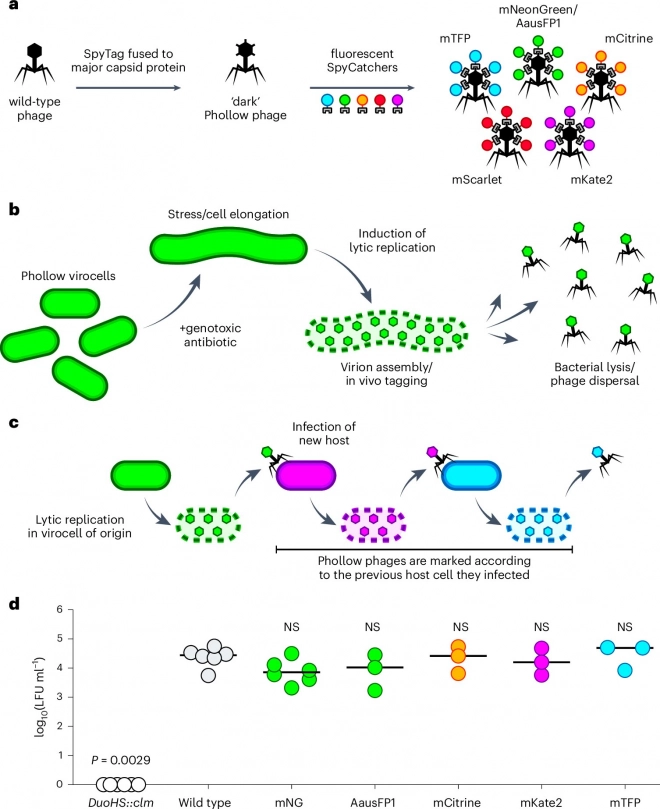
В исследовании "Phollow выявляет динамику передачи фагов in situ в микробиоме кишечника рыбок данио с разрешением на уровне отдельных вирионов", опубликованном в Nature Microbiology, исследователи разработали метод визуализации в реальном времени для изучения того, как бактериофаги размножаются и распространяются в бактериальных сообществах и организмах-хозяевах.
Phollow применялся в бесклеточных организмах рыбок данио, колонизированных модифицированными штаммами E. coli и Plesiomonas, что позволило визуализировать поведение фагов с разрешением на уровне отдельных вирионов. Исследователи создали фаги с флуоресцентными метками и ввели их в модифицированные бактериальные клетки-хозяева, называемые Phollow-вироцитами.
Репликацию вируса вызывали с помощью антибиотиков, а активность фага отслеживали in vivo с помощью покадровой съёмки, микроскопии сверхвысокого разрешения, проточной вирометрии и экспансионной микроскопии. Было замечено, что фаги Phollow образуют вирусные агрегаты, которые после лизиса бактерий распадаются на облака быстро распространяющихся частиц. Пик вирусной репликации наблюдался через час после обработки митомицином С и затрагивал примерно 20 процентов популяции бактерий.
Дизайн, конструкция и инфекционность фагов Phollow. Источник: Nature Microbiology (2025). DOI: 10.1038/s41564-025-01981-1
На пике репликации вироциты Phollow содержали в среднем 1,6 вирусных очага на микрон длины клетки. Трёхмерные проекции показали, что площадь поверхности вирусных очагов примерно в 100 раз больше, чем у одного фагового капсида, подобного P2. Просвечивающая электронная микроскопия не выявила явных структурных различий между вирионами фагов дикого типа и Phollow.
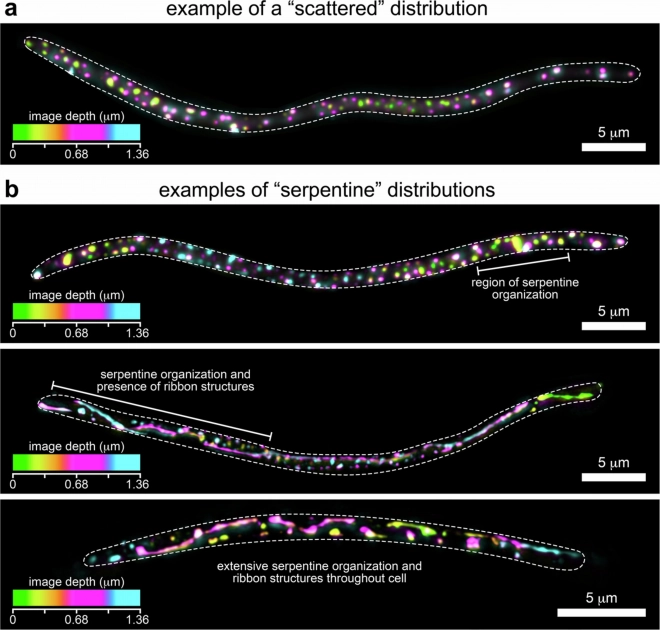
Поточная вирометрия показала, что митомицин С, ципрофлоксацин и триметоприм вызывают сопоставимый пиковый выход вирионов. Вспышки, вызванные триметопримом в кишечнике рыбок данио, в течение четырёх часов приводили к образованию облаков фагов по всему кишечнику, которые в основном исчезали к 24-му часу. Пик выхода инфекционных вирионов в тканях кишечника достигался через четыре часа и сохранялся в окружающей воде в течение 24 часов. Фаги, полученные из плезимонад, распространялись по организму в печень и мозг.
В лабораторных условиях было обнаружено, что фаги Phollow реплицируются в новых клетках-хозяевах и передаются между бактериями. В естественных условиях вторая волна репликации фагов подтвердила, что произошла горизонтальная передача. Первоначальное тестирование Phollow показало, что он позволяет проводить многомасштабные исследования передачи фагов и межвидовых взаимодействий, что может открыть новые возможности для лечения микробиома на основе фагов.
Методы визуализации в реальном времени и проточной вирометрии могут помочь в разработке экспериментальных планов, направленных на изучение механизмов вспышек фагоинфекции, что открывает множество неиспользованных клинических возможностей.
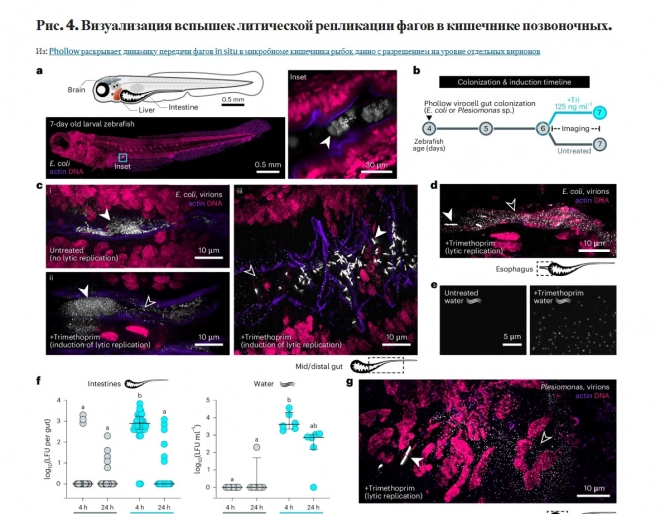
Фото и видео: Nature Microbiology (2025). DOI: 10.1038/s41564-025-01981-1


Обсуждение ( 0 ) Посмотреть все